2023 (8)
Nota Técnica N°7 - Noviembre 2023
Enfermedad Bacteriana del Riñón (BKD)
Tendencia, diagnóstico y terapia
En nuestra Nota Técnica N°6 detallamos los factores predisponentes para la Renibacteriosis (BKD), causada por Renibacterium salmoninarum (Rs). A continuación, indicaremos algunas consideraciones acerca de quimioterapia frente a esta enfermedad, así como de las herramientas diagnósticas disponibles, de alta sensibilidad, para detectar el patógeno en peces y fomites, aprovechando, además, de hacer algunos comentarios en función del análisis de nuestra base de datosAlgunas consideraciones acerca de quimioterapia(basadas en publicaciones, experiencia de múltiples casos clínicos y estudios internos)
1. Los casos clínicos en mar frecuentemente provienen de infecciones subclínicas en agua dulce.
2. Los fármacos utilizados, en orden de eficacia, son:
Eritromicina (E): Acción bactericida a altas dosis, a bajas concentraciones es bacteriostático. Alta eficacia para controlar cuadro clínico; por un tiempo extenso la mortalidad permanece baja, sin evidencia de signología. Desventajas: temas de mercado, palatabilidad (es altamente complejo a baja temperatura).
Oxitetraciclina (OTC): Acción bacteriostática. Alta eficacia para controlar cuadro clínico, especialmente cuando es parenteral. Por vía oral es más lenta su acción, pero efectiva. La mortalidad permanece baja y sin evidencia de signología por menos tiempo respecto a Eritromicina. Desventajas: temas de mercado y, a baja temperatura, se complejiza eventualmente alcanzar la dosis terapéutica en alimento.
Florfenicol (FFC): Acción bacteriostática. Alta eficacia para controlar cuadro clínico. Desventajas: breve tiempo de acción, es decir, ya en un par meses podría observarse reaparición del cuadro clínico,incluso rebrote. Dura más tiempo su eficacia si la terapia es temprana, cuando hay un porcentaje bajo de portadores, muy escasos o excepcionales peces con signología, sin que haya brote previo.
3. La bacteria podría mantenerse “protegida” en el tejido nervioso después de las terapias (especialmente importante a temperaturas bajas), pues hay un filtro muy selectivo llamado “barrera hematoencefálica”. Eritromicina, Oxitetraciclina y Flofenicol podrían atravesar esta barrera dependiendo de la dosis administrada. Sólo si esta es elevada podría alcanzar concentraciones terapéuticas en el líquido cefalorraquídeo (hay variaciones entre antibacterianos).
Prevalencia de BKD (RT-PCR) acorde a base de datos de ADL - 2020 al 2022
En los últimos 3 años, acorde con la base de datos de PCR de ADL (prom 34 mil RT-PCR/año) para el diagnóstico de R. salmoninarum, observamos que desde el 2020 al 2022 la cantidad de casos positivos informados se ha triplicado (Gráfico 1). En el análisis, además, hemos incluido las amplificaciones tardías (negativos con Ct).

Respecto de la prevalencia por especie, la literatura indica que la especie más susceptible es el salmón coho, seguido de salar y luego truchas. En la gráfica 2 observamos que los casos positivos en salmón coho se incrementan de manera importante hacia el 2022. Enfatizamos en la importancia de los factores predisponentes anteriormente expuestos, en especial el vacío sanitario, las medidas de bioseguridad y la certificación de reproductores/ovas, fundamentales en la introducción, propagación y contagio.

En ADL, desde hace años contamos con técnicas altamente sensibles, como son ADLMag® y UFT, las que logran amplificar la sensibilidad en más de 1.000 veces respecto del PCR, pudiéndose evaluar diferentes matrices complejas (agua de afluente/efluente, sedimento, superficies y RILes, entre otros).
Complementariamente, hemos innovado en el desarrollo de técnicas que permiten la detección de anticuerpos, como es el caso de ELISA IgM anti- R. salmoninarum en suero (seroprevalencia), la cual permite determinar si los peces han estado en contacto con el agente causal de BKD. El desarrollo se originó dada la seria dificultad de detectar el agente en poblaciones sanas, en donde la prevalencia por PCR es excepcionalmente baja a nula, pero luego en mar aparece positividad, a veces signología e incluso leve incremento de la mortalidad en algunos casos. Esto se expuso en la Nota Técnica Nº 3 (abril 2023), en donde frente a casos negativos a PCR, ELISA IgM anti-Rs detectó presencia de anticuerpos en una fracción variable de la población.
Igualmente, estamos incursionando en la detección temprana del agente en tejidos distintos a riñón, con resultados promisorios, lo que se presentará en próximas notas técnicas.
Signos clínicos y relación con diagnóstico (RT-PCR)
En la literatura científica se menciona que los signos clínicos pueden ser observados desde las 4 semanas o meses post-infección. En estudios de ADL en salares, en ambiente controlado, la mortalidad comienza desde los 30 a 40 días post-desafío ip. La presencia de signos clínicos puede verse influenciada por el estadio de los peces, las condiciones de cultivo y el estado inmunológico, entre otros. En etapas tempranas de la enfermedad, se pueden identificar signos inespecíficos, como renomegalia en forma única, esplenomegalia o solo congestión de la cavidad abdominal, pero también en etapas incipientes de la enfermedad se observan signos más clásicos de BKD, tales como granulomas únicos o múltiples en alguno de los órganos target (riñón, bazo y/o hígado). En la experiencia de ADL, se ha podido relacionar la aparición de signos clínicos cuando los resultados de PCR indican Ct iguales o inferiores a 26, y en pleno brote se llega a alcanzar Ct hasta de 13 a 14.

Bibliografía
· Balfry, S.; Brown, L. 2006. Feasibility of Selective Breeding for Resistance to Bacterial Kidney Disease: Current State of Knowledge. BCMAFF, Fish Health Management Committee. 1-38.
· Bruno, D. 2004. Prevalence and diagnosis of bacterial kidney disease (BKD) in Scotland between 1990 and 2002. Dis Aquat Org Vol. 59: 125–130.
· Brown, L.; Albright, L.; Evelyn, T. 1990. Control of vertical transmission of Renibacterium salmoninarum by injection of antibiotics into maturing female coho salmon Oncorhynchus kisutch. Dis. aquat. Org. Vol. 9: 127-131
· Griffiths, S.; Melville, K.; Saloniuns, K. 1998. Reduction of Renibacterium salmoninarum culture activity in Atlantic salmon following vaccination with avirulent strains. Fish & Shellfish Immunology 8, 607–619
· Dale, O.; Gutenberger, S.; Rohovec, J. 1997. Estimation of variation of virulence of Renibacterium salmoninarum by survival analysis of experimental infection of salmonid fish. Journal of Fish Diseases, 20, 177– 183
· Elliott, D.; Wiens, G.; Hammell, H.; Rhodes, L. 2014. Fish Vaccination. Chapter 22: Vaccination against Bacterial Kidney Disease.
· Elliott, D.; Pascho, R.; Bullock, G. 1989. Developments in the control of bacterial kidney disease of salmonid fishes. Dis. aquat. Org. Vol. 6: 201-215
· Flores S.; Valdivia S.; Blanco J.; Isla A.; Contreras A.; Arcos C.; Yáñez A. 2022. Renibacterium salmoninarum una amenaza latente en la industria salmonera. Rev. Versión Diferente No. 35. Pag 18-21
· Fisheries and Oceans Canada (DFO). 2010. Evaluation of Bacterial Kidney Disease (BKD) Impacts on the Canadian Salmon Aquaculture Industry. Pag. 1-24
· González, Marcelo. Tesis de Grado, 2004. Determinación de la mortalidad y posibles efectos teratógenos de los antibióticos Enrofloxacino, Eritromicina y la desinfección de yodo de las ovas de salmón coho y salmón del Atlántico.
· Kristmundsson, A.; Arnason, F.; Gudmundsdottir, S.; Antonsson, T. 2016. Levels of Renibacterium salmoninarum antigens in resident and anadromous salmonids in the River Ellidaar system in Iceland. Journal of Fish Diseases, 39, 681-692
· Lee, E.; Evelyn, T. 1989. Effect of Renibacterium salmoninarum levels in the ovarian fluid of spawning chinook salmon on the prevalence of the pathogen in their eggs and progeny. Dis. aquat. Org. Vol 7:179-184
· Lee, E.; Evelyn, T. 1994. Prevention of vertical transmission of the bacterial kidney disease agent Renibacterium salmoninarum by broodstock injection with erythromycin. Dis. aquat. Org. Vol. 18:1-4
· Murray, A.; Munro, L.; Wallace, I.; Allan, C.; Peeler, E.; Thrush,M. 2012. Epidemiology of Renibacterium salmoninarum in Scotland and the potential for compartmentalised management of salmon and trout farming areas. Aquaculture 324–325 1–13.
· Rozas M.; Lobos C.; Correa R.; Ildefonso R.; Vásquez J.; Muñoz A.; Maldonado L.; Jaramillo V.; Coñuecar D.; Oyarzún C.; Walker R.; Navarrete C.; Gayosa J.; Mancilla P.; Peña A.; Senn C.; Schwerter F. 2020. Atlantic Salmon Pre-smolt Survivors of Renibacterium salmoninarum Infection Show Inhibited Cell-Mediated Adaptive Immune Response and a Higher Risk of Death During the Late Stage of Infection at Lower Water Temperatures, Front. Immunol., Vol 11. Pag 1—18
· Grandón, M., Irgang, R., Avendaño-Herrera, Rubén. 2020. Proposed protocol for performing MIC testing to determine the antimicrobial susceptibility of Renibacterium salmoninarum in Chilean salmon farms. J Fish Dis.00: 1–10.
· Sernapesca, septiembre 2022, Informe sanitario con información sanitaria de agua dulce y mar 1° semester año 2022, subdirección de acuicultura, deparamento de salud animal.
· Starliper, C.; Teska, J. 1995. Relevance of Renibacterium salmoninarum in an asymptomatic carrier population of brook trout, Salvelinus fontinalis fMitchillj. Journal of Fish Diseases 18.383-387
· Sprague Hamel, O. 2011. The Dynamics and Effects of Bacterial Kidney Disease in Snake River Spring Chinook Salmon (Oncorhynchus tshawytscha). Pag. 1-200
· Wallace, I.; Munro, L.; Murray, A.; Christie, A.; Salama, N. 2016. A descriptive analysis of Scottish farmed Atlantic salmon, Salmo salar L., movements identifies a potential disease transmission risk from freshwater movements. Journal of Fish Diseases
Nota Técnica N°6 Enfermedad Bacteriana del Riñón
Septiembre 2023
Enfermedad Bacteriana del Riñón (BKD):
Factores predisponentes
La Renibacteriosis (BKD), causada por Renibacterium salmoninarum (Rs), es una enfermedad infecciosa cosmopolita caracterizada por producir lesiones granulomatosas multifocales en órganos internos, principalmente el riñón, tanto en salmónidos silvestres como de cultivo en todo el mundo. Esta enfermedad es de naturaleza progresiva, afectando las etapas de agua dulce y engorda en mar. La mayor vulnerabilidad en las especies cultivadas en Chile la posee salmón coho (Oncorhynchus kisutch), luego le sigue salmón del Atlántico (Salmo salar) y en mucho menor medida la trucha arcoiris (Oncorhynchus mykiss). La enfermedad presenta un largo período de incubación y clínicamente rara vez se observa en peces menores a 6-12 meses.
De acuerdo con la estadística de SERNAPESCA, expuesta en septiembre del 2022, la mortalidad asociada a BKD en la industria nacional ha presentado un aumento oscilante en las distintas especies durante los últimos años. El incremento se puede apreciar marcadamente en agua de mar, tanto para los salares, como para las truchas, mientras que en salmón coho presenta un leve descenso, ocurriendo una situación inversa en agua dulce para esta última especie (SERNAPESCA, 2022).
Después de hacer una amplia revisión bibliográfica, consideramos que podría ser de mayor interés los factores predisponentes de la enfermedad, de manera que en las siguientes líneas enfatizamos sobre ellos.

FACTORES PREDISPONENTES
DESCANSO SANITARIO:
Es una medida altamente efectiva y primordial para la reducción significativa de BKD, asociada a la desinfección de instalaciones.
El sistema all in/all out ayuda bastante a reducir la carga del agente en el ambiente y posibles brotes futuros.
El agua y sedimento se consideran reservorios poco probables de reinfección, en comparación con la fauna acuática silvestre. También se ha demostrado que las fecas son un vector importante para la enfermedad.
El ingreso de peces infectados, posterior al descanso sanitario, reintroduce R. salmoninarum y genera transmisión horizontal. Es relevante conocer en detalle del origen de los peces y realizar muestreos representativos con técnicas de alta sensibilidad, previo a todo ingreso.
BIOSEGURIDAD:
La restricción en el movimiento de ovas y smolt desde áreas con presencia del agente es una medida básica, la que debe ser considerada siempre frente a un movimiento desde centros emisores a receptores.
La reducción de la prevalencia de BKD en agua dulce presenta beneficios sustanciales para limitar la enfermedad e impacto económico en la fase marina. Por lo tanto, los movimientos de equipos y material contaminados son un potencial riesgo de incorporar o mover al agente. Los camiones de transporte de peces se han identificado como un fuerte factor de riesgo si hay falla en el proceso de desinfección.
REPRODUCTORES Y SCREENING:
La transmisión dual (horizontal y vertical) favorece la persistencia de R. salmoninarum, complejizando las estrategias de control y manejo.
Cuando existe infección intraova, la bacteria no se ve afectada por la desinfección de las ovas, pues el desinfectante no penetra al interior de la ova, solo actúa en la superficie exterior, por lo tanto, este manejo por sí solo no es eficaz en el control de transmisión vertical de la enfermedad. La infección intraova promueve la posterior transmisión horizontal entre la progenie en etapas posteriores, sobretodo si la temperatura favorece el desarrollo de la bacteria.
El screening de reproductores de forma rutinaria se considera como la opción más relevante para controlar la transmisión vertical. Con prácticas de segregación y/o eliminación selectiva de progenie, de reproductores infectados, se ha demostrado reducir la prevalencia y gravedad de BKD en generaciones posteriores. Para este caso, las técnicas moleculares (PCR) son las más apropiadas.
ESTRÉS: TEMPERATURA
Existe una relación directa entre la temperatura del agua y los brotes de la enfermedad, por lo tanto, se debe considerar como un factor de riesgo. Según bibliografía, con altas temperaturas las tasas de mortalidad son más altas y lo signos más leves, mientras que con temperaturas bajas ocurre lo contrario. Entre 15 a 20°C el tiempo medio de muerte de peces es 25 días, mientras que peces cultivados a 4°C tienen un tiempo medio de muerte de 70 días. Cohos infectados artificialmente en agua dulce presentan curvas de mortalidad más altas, en rangos de 6 a 12 °C, mientras que de 12 a 20°C la curva de mortalidad disminuye y también confirma que el tiempo medio de muerte disminuye al aumentar la temperatura.
El estrés (fisiológico o por manejo) puede aumentar la susceptibilidad de los peces a BKD. El mecanismo que explica esto se asocia con el efecto del cortisol y su efecto inmunodepresor.
AFLUENTES
Rs puede sobrevivir 4 días en agua de río, 3 semanas en fecas, 4 a 5 semanas en agua dulce estéril y 2 semanas en agua de mar estéril. Bacterias libres y aquellas contenidas en fecas, provenientes de aguas arriba, son importantes en la transferencia de la enfermedad entre las poblaciones, por lo tanto, el monitoreo de los afuentes con técnicas de alta concentración y amplificadoras, de sensibilidad muy elevada, disponibles en ADL, como ADLMag® o Ultrafiltración Tangencial (UFT)®, son herramientas claves para el monitoreo de Rs.
SELECCIÓN GENÉTICA
Las ganancias genéticas son acumulativas en el trasncurso de las generaciones. La selección de índices genéticos produce mejoras sustanciales en el rendimiento en agua dulce y mar. La aplicación de selección para el desarrollo de poblaciones más resistentes a diferentes patógenos es una potente herramienta para el control de ciertas enfermedades, pues es una solución más permanente en el tiempo para reducir las pérdidas, comparado con vacunas o antibióticos.
ESMOLTIFICACIÓN
Desde hace años es bien sabido que la esmoltificación implica cambios fisiológicos y que, por consecuencia, aumentan el cortisol y afectan las funciones del sistema inmune, lo que podría permitir un aumento en la patogenicidad de Rs. La inmunosupresión puede contribuir a la generación de infecciones secundarias u oportunistas que pudieran ser en algunos casos las causantes finales de la mortalidad.
NUTRICIÓN
Los cambios en las dietas podrían ser un factor que contribuye al incremento de prevalencia de BKD. Estos cambios tienen relación con el aumento en la proporción de proteina vegetal y la sustitución de grasas de origen animal. La calidad y fuente de lípidos puede tener efecto sobre la susceptibilidad a BKD, ya que la dieta puede afectar la función de inmunidad innata y específica, comprometiendo la resistencia a BKD.
Respecto a los minerales, hay investigadores que han demostrado que tienen un efecto frente a infección por BKD, apuntando, principalmente, al rol de fluor y yodo en salares.
Respecto a los suplementos nutricionales, han tenido resultados contradictorios. Actualmente, existen alimentos funcionales que pudieran generar un efecto positivo, pero aún no ha sido lo suficientemente probado para BKD.
DENSIDAD
Está demostrado que elevadas densidades aumentan la prevalencia de la infección por BKD. Una densidad elevada se traduce en tasas más altas de infección, atribuibles como respuesta al estrés fisiológico. Como se vio en los puntos anteriores, el mayor potencial para la transmisión horizontal es por medio de vía fecas-oral.
Considerar todos estos factores predisponentes, sin duda, ayudarán a un mejor manejo y control de BKD. En nuestra próxima nota técnica (Nº 7) abordaremos las tendencias en los últimos años en torno a esta enfermedad, así como su diagnóstico y terapias más frecuentes.
Bibliografía
• Balfry, S.; Brown, L. 2006. Feasibility of Selective Breeding for Resistance to Bacterial Kidney Disease: Current State of Knowledge. BCMAFF, Fish Health Management Committee. 1-38.
• Bruno, D. 2004. Prevalence and diagnosis of bacterial kidney disease (BKD) in Scotland between 1990 and 2002. Dis Aquat Org Vol. 59: 125–130.
• Brown, L.; Albright, L.; Evelyn, T. 1990. Control of vertical transmission of Renibacterium salmoninarum by injection of antibiotics into maturing female coho salmon Oncorhynchus kisutch. Dis. aquat. Org. Vol. 9: 127-131
• Griffiths, S.; Melville, K.; Saloniuns, K. 1998. Reduction of Renibacterium salmoninarum culture activity in Atlantic salmon following vaccination with avirulent strains. Fish & Shellfish Immunology 8, 607–619
• Dale, O.; Gutenberger, S.; Rohovec, J. 1997. Estimation of variation of virulence of Renibacterium salmoninarum by survival analysis of experimental infection of salmonid fish. Journal of Fish Diseases, 20, 177– 183
• Elliott, D.; Wiens, G.; Hammell, H.; Rhodes, L. 2014. Fish Vaccination. Chapter 22: Vaccination against Bacterial Kidney Disease.
• Elliott, D.; Pascho, R.; Bullock, G. 1989. Developments in the control of bacterial kidney disease of salmonid fishes. Dis. aquat. Org. Vol. 6: 201-215
• Flores S.; Valdivia S.; Blanco J.; Isla A.; Contreras A.; Arcos C.; Yáñez A. 2022. Renibacterium salmoninarum una amenaza latente en la industria salmonera. Rev. Versión Diferente No. 35. Pag 18-21
• Fisheries and Oceans Canada (DFO). 2010. Evaluation of Bacterial Kidney Disease (BKD) Impacts on the Canadian Salmon Aquaculture Industry. Pag. 1-24
• González, Marcelo. Tesis de Grado, 2004. Determinación de la mortalidad y posibles efectos teratógenos de los antibióticos Enrofloxacino, Eritromicina y la desinfección de yodo de las ovas de salmón coho y salmón del Atlántico.
• Kristmundsson, A.; Arnason, F.; Gudmundsdottir, S.; Antonsson, T. 2016. Levels of Renibacterium salmoninarum antigens in resident and anadromous salmonids in the River Ellidaar system in Iceland. Journal of Fish Diseases, 39, 681-692
• Lee, E.; Evelyn, T. 1989. Effect of Renibacterium salmoninarum levels in the ovarian fluid of spawning chinook salmon on the prevalence of the pathogen in their eggs and progeny. Dis. aquat. Org. Vol 7:179-184
• Lee, E.; Evelyn, T. 1994. Prevention of vertical transmission of the bacterial kidney disease agent Renibacterium salmoninarum by broodstock injection with erythromycin. Dis. aquat. Org. Vol. 18:1-4
• Murray, A.; Munro, L.; Wallace, I.; Allan, C.; Peeler, E.; Thrush,M. 2012. Epidemiology of Renibacterium salmoninarum in Scotland and the potential for compartmentalised management of salmon and trout farming areas. Aquaculture 324–325 1–13.
• Rozas M.; Lobos C.; Correa R.; Ildefonso R.; Vásquez J.; Muñoz A.; Maldonado L.; Jaramillo V.; Coñuecar D.; Oyarzún C.; Walker R.; Navarrete C.; Gayosa J.; Mancilla P.; Peña A.; Senn C.; Schwerter F. 2020. Atlantic Salmon Pre-smolt Survivors of Renibacterium salmoninarum Infection Show Inhibited Cell-Mediated Adaptive Immune Response and a Higher Risk of Death During the Late Stage of Infection at Lower Water Temperatures, Front. Immunol., Vol 11. Pag 1—18
• Grandón, M., Irgang, R., Avendaño-Herrera, Rubén. 2020. Proposed protocol for performing MIC testing to determine the antimicrobial susceptibility of Renibacterium salmoninarum in Chilean salmon farms. J Fish Dis.00: 1–10.
• Sernapesca, septiembre 2022, Informe sanitario con información sanitaria de agua dulce y mar 1° semester año 2022, subdirección de acuicultura, deparamento de salud animal.
• Starliper, C.; Teska, J. 1995. Relevance of Renibacterium salmoninarum in an asymptomatic carrier population of brook trout, Salvelinus fontinalis fMitchillj. Journal of Fish Diseases 18.383-387
• Sprague Hamel, O. 2011. The Dynamics and Effects of Bacterial Kidney Disease in Snake River Spring Chinook Salmon (Oncorhynchus tshawytscha). Pag. 1-200
• Wallace, I.; Munro, L.; Murray, A.; Christie, A.; Salama, N. 2016. A descriptive analysis of Scottish farmed Atlantic salmon, Salmo salar L., movements identifies a potential disease transmission risk from freshwater movements. Journal of Fish Diseases
Nota Técnica nº 5: IPN en Chile: nuevas variantes, nuevos desafíos
El virus de la Necrosis Pancreática Infecciosa (IPNv), enfermedad controlada en la salmonicultura nacional, sigue dando a ratos algunos dolores de cabeza, incluso en Noruega y Escocia. IPNv está presente en Chile desde hace casi cuatro décadas, las evidencias han mostrado que el virus procedía desde Norteamérica, presumiblemente siendo introducida a través de las ovas; si bien la transmisión vertical está científicamente demostrada sólo en truchas, las múltiples evidencias permiten dar por hecho que esto mismo ocurre en salmón del Atlántico y salmón coho.
A través de los años, se han implementado en el país una serie de estrategias que han permitido controlar efectivamente la enfermedad, entre las que destacan el uso de vacunas, mejores prácticas de cultivo y de bioseguridad y, en especial, para el caso de salmón del Atlántico, la selección de peces genéticamente resistentes al virus (QTL y ahora agregando más marcadores genéticos). Como muchas veces sucede, este virus es más “inteligente” de lo que pensamos, reportándose algunos brotes asociados a mortalidades por IPN desde el 2021 a la fecha, incluso en peces QTL, lo que se ha asociado a la aparición de nuevas variantes genéticas (mutaciones) del virus. Estas mortalidades han sido muy variables en porcentaje, sin embargo, en algunos casos de mortalidades bajas, se han generado pérdidas más elevadas de lo pensado, específicamente atribuidas a peces con menor rendimiento productivo, que se van quedando rezagados; algo característico de la versión crónica de IPN que era común de observar en brotes con mortalidades de importancia.
Cepas y clasificación
En cuanto a la clasificación de las cepas del virus IPN, existen dos enfoques: uno basado en las características serológicas y otro en la variabilidad genotípica. A nivel serológico, se describen los serogrupos A y B, dentro del primero (serogrupo A) existen nueve serotipos, mientras que en el serogrupo B solo hay un serotipo. Por su parte, el enfoque genotípico clasifica las distintas cepas en siete genotipos (G1 a G7). Por cierto, existeuna relación entre los distintos serotipos, genotipos y cepas.
En Chile, se ha reportado casi de manera exclusiva la cepa americana West Buxton (WB, genotipo 1, serotipo A1) en trucha arco iris y salmón coho, mientras que la cepa danesa Spajarup (Sp, genotipo 5, serotipo A2) se ha reportado casi exclusivamente en salmón del Atlántico, lo que sugiere una relación especifica con el hospedero.
Figura 1

En ADL, además de disponer de la técnica de RT-qPCR para la identificación de IPNv mediante el uso de marcadores moleculares específicos, también se cuenta con RT-qPCR específicos para los serotipos West Buxton (WB) y Spajarup (Sp), que son aquellos más frecuentes en Chile, sumándose además los marcadores de virulencia para el serotipo Sp, que nos permite discriminar en función de esa variable.
Dado que una fracción importante de los peces en la industria recibe la vacuna IPNv de Pharmaq, que utiliza una variante noruega de Sp que no está presente en Chile, es que ADL hace más de 8 años desarrolló una técnica específica a la que hemos denominado RT-qPCR no interferencia Pharmaq (NPHQ) y RT-qPCR vacuna Pharmaq (VacPh), que permiten discriminar si la positividad a IPNv en peces inmunizados se asocia a marcadores específicos de la vacuna o bien corresponde efectivamente a una
infección natural. Estos, han sido utilizados en muchos casos por varios años, pues aportan valiosa información para interpretar situaciones en las cuales existe incertidumbre y se requiere certeza para generar las intervenciones o medidas que corresponden. Esto se ha hecho más necesario toda vez que estas vacunas han dado reacción cruzada a IPNv incluso en peces recién transferidos al mar. Ciertamente, esta discriminación no se puede llevar a cabo con vacunas que usan virus de IPN presentes en Chile.
Figura 2

Características del virus
IPNv es un virus icosaédrico sin envoltura, con un tamaño promedio de 65 nm. Una de las principales características del agente es la gran resistencia a condiciones físico-químicas, se mantiene estable a valores de pH cercanos a 3, soporta un amplio rango de salinidades (0 a 40 ppt) y temperaturas (resiste hasta 60°C durante 30 minutos, siendo capaz de replicarse en temperaturas que van desde los 4° a 27,5 °C). Por otro lado, se reconoce que los peces sobrevivientes a la infección se convierten en portadores asintomáticos de por vida, diseminando el virus a través de sus heces y/o gametos. Estos factores determinan en gran parte el endemismo del virus y su difícil control.
Otra característica del IPNv es su variada virulencia, reportándose diferencias incluso en cepas de un mismo tipo. Un componente viral ampliamente estudiado en este ámbito es la proteína VP2, proteína estructural de la cápside viral que contiene los principales sitios antigénicos, la especificidad celular de unión a células del hospedero y algunos determinantes de virulencia. Diversos estudios han identificado que diferencias en las secuencias aminoacídicas de VP2 actúan como determinantes de virulencia, destacando particularmente los cambios en las posiciones 217, 221 y 247. La identificación de mutaciones en VP2, ha sido de gran relevancia ya que podrían explicar la reciente adaptación del virus en salmones genéticamente resistentes. Los análisis de virulencia, basados en este criterio científico, forman parte de la batería de análisis realizados en ADL hace más de una década y nos ha permitido incluso realizar estudios en casos clínicos diversos y en vacunas.
Una innovación tecnológica relevante en la industria mundial y que fue responsable de controlar efectivamente IPN en salmón del Atlántico, superando con creces la contribución de la vacuna, fue la generación de poblaciones genéticamente resistentes al virus (QTL); específicamente hacia el serotipo Sp. Después de muchos años de funcionar perfectamente, de pronto el virus muta y se presentan algunos brotes en Noruega y Escocia, como también en Chile.
Investigaciones realizadas por ADL, en conjunto con el Norwegian Veterinary Institute (NVI), utilizando poblaciones de salmón del Atlántico genéticamente resistentes, pero afectados por brotes de IPN desde fines 2021 y durante el año 2022 en Chile, permitieron determinar que existen mutaciones espontáneas que afectan algunos residuos aminoacídicos de VP2 de aislados recientes. A lo anterior, se suma una investigación realizada de manera independiente por ADL en una serie de casos de la misma temporada, en los cuales se recuperó e identificó aislados del genogrupo I (WB). La secuenciación del genoma de dichos aislados confirmó mutaciones en el segmento B, la mayoría de ellas sobre el gen que codifica para la proteína VP2, los que vendrían siendo los primeros casos documentados de salares genéticamente resistentes afectados por este tipo de cepa.
Si bien, no es posible establecer con certeza que los cambios detectados a nivel de secuencia sean responsables de la capacidad de estos nuevos aislados de infectar peces genéticamente resistentes, este hecho pone en evidencia la gran capacidad de adaptación del virus y la posibilidad de generar variantes genéticas con nuevas características, las que podrían ser más virulentas, afectar un rango más amplio de hospederos y presentar mayor resistencia a condiciones ambientales, entre otros. Estas mutaciones fueron comparativamente más amplias, y por lo mismo más complejas, en Noruega y Escocia respecto de Chile.
Para mantener protegida a la industria de esta importante enfermedad, se hace necesaria una vigilancia epidemiológica molecular rigurosa y continua sobre los diferentes genotipos del virus IPN, de manera de estudiar si potenciales mutaciones podrían ser responsables de quiebres en la resistencia genética al virus, las cuales necesariamente deben ser comprobadas en peces, en ensayos de desafío en ambiente controlado. Esta vigilancia debe ser acompañada de inmunización activa (vacunas) y de medidas de control y prevención oportunas y adecuadas.
Bibliografía
Dopazo, C. (2020). The Infectious Pancreatic Necrosis Virus (IPNV) and its Virulence Determinants: What is Known and What Should be Known. Pathogens 9 (2):94.
Hillestad, B., Johannessen, S., Melingen, G. O., & Moghadam, H. K. (2021). Identification of a New Infectious Pancreatic Necrosis Virus (IPNV) Variant in Atlantic Salmon (Salmo salar L.) that can Cause High Mortality Even in Genetically Resistant Fish. Front Genet, 12, 635185. doi:10.3389/fgene.2021.635185.
Kuznar, J. Virus IPN: La importancia de la caracterización molecular y el contexto epidemiológico de aislados chilenos. Salmonexpert, 24.02.2018
Tapia, D., Barria, A., Kuznar, J., & Yanez, J. M. (2020). Comparison of mortality and viral load in rainbow trout (Oncorhynchus mykiss) infected with infectious pancreatic necrosis virus (IPNV) genogroups 1 and 5. J Fish Dis, 43(1), 139-146.
Wong-Benito, V., Barraza, F., Trujillo-Imarai, A., Ruiz-Higgs, D., Montero, R., Sandino, A. M., . . . Imarai, M. (2022). Infectious pancreatic necrosis virus (IPNV) recombinant viral protein 1 (VP1) and VP2-Flagellin fusion protein elicit distinct expression profiles of cytokines involved in type 1, type 2, and regulatory T cell response in rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol, 131, 785-795.
Nota Técnica N°4: EVALUACIÓN ONTOGÉNICA: Una herramienta diagnóstica que aporta valiosa información de procesos que siendo relevantes pueden pasar inadvertidos.
11 de Mayo 2023
Elaborado por: Área Asistencia Técnica - ADL Diagnostic Chile
Hablar de Ontogenia en la patología de peces no es algo fácil, mucho menos comprender su importancia y utilidad práctica desde una perspectiva fisiopatológica. La razón es que no estamos familiarizados con estos conceptos y disciplinas. No son nuevas en la medicina humana, pero sí pioneras e innovadoras en la salud de los peces. El trabajo que hemos estado llevando a cabo estos 2 últimos años en relación a Ontogenia, y otras materias relacionadas, no sólo nos ha ampliado la visión y el alcance diagnóstico sino también darnos cuenta que anterior al uso de estas nuevas herramientas no estábamos en algunos casos advirtiendo hallazgos relevantes que nos hubiesen ayudado mucho a entender mejor el problema, a diagnosticar de manera más precisa y por lo mismo a mejorar el pronóstico y las recomendaciones. La Ontogenia es un área de la biología del desarrollo que describe los cambios morfológicos de un ser vivo, desde la fecundación hasta el final de su vida. Si bien se cruza en un momento con el desarrollo embrionario, no se queda únicamente ahí, sino que abarca también el estudio de los cambios producidos en estados posteriores del individuo, ya sean celulares, tisulares o anatómicos. Estos cambios, pueden considerarse normales dentro del desarrollo, así como también cambios anormales, y que son desencadenados principalmente por alteraciones ambientales, modificando la activación génica, así como la estructura y funcionalidad de algún tejido, órgano o sistema.
En la medicina poblacional, como es el caso de la acuicultura, la mirada suele casi exclusivamente centrarse en los cambios de naturaleza patológica, vale decir, en aquellas lesiones o trastornos que se producen por la acción de alguna noxa, sea esta biológica (bacterias, virus, parásitos) o no biológica (tóxicos, genéticas, ambientales, etc.), como por ejemplo: tumefacciones, inflamaciones, degeneraciones, necrosis, fibrosis o distintos tipos de proliferaciones celulares, por mencionar algunas. Los tipos o características de las alteraciones, como sabemos, permiten muchas veces construir hipótesis y sospechas acerca de un cuadro clínico específico o enfermedad en particular, ya sea de carácter biológico o no, la que con el apoyo de diversas técnicas, finalmente, en una importante cantidad de veces se hace posible formular un diagnóstico como tal, y en consecuencia un pronóstico de la condición e intervención de la misma. Es importante señalar que, conforme se generan trastornos o alteraciones que caracterizan una determinada patología, al mismo tiempo el organismo reacciona ante esas amenazas o peligros percibidos desarrollando una serie de complejas respuestas fisiológicas que determinan finalmente la capacidad del individuo de adaptarse o no a la injuria o daño recibido. En este notable proceso, el organismo modifica y adecúa una serie de respuestas y reacciones tisulares, las que están por cierto íntimamente asociadas al tipo e intensidad en que se hayan manifestado, generando cambios fisiológicos y morfológicos, los que se constituyen en la respuesta del organismo frente a ese estresor.
El punto relevante aquí es que, si bien los cambios adaptativos posteriores a un proceso patológico se resuelven normalmente de una forma adecuada y sin consecuencias para la vida del individuo, cabe la posibilidad que éstos no sean compatibles con un adecuado rendimiento productivo posterior (crecimiento, conversión) y deriven en disfuncionalidades importantes no siempre advertidas por la forma en que realizamos el diagnóstico, debido a que los cambios que se presentan no poseen las características convencionales propias de una lesión o alteración patológica propiamente tal, como por ejemplo fibrosis, necrosis, proceso inflamatorio, trastornos vasculares y/o proliferativos, entre otros. En tales casos, lo que se observan son cambios que están dentro de una normalidad celular, es decir, respuestas fisiológicas que se condicen con la normal capacidad de adaptación y reparación, pero que por su naturaleza se traducen y convierten en problemas estructurales y funcionales, que impiden la normal expresión genética productiva del individuo, limitando sus capacidades, lo que se traduce finalmente en pérdida. Como ejemplo, en la Figura 1, se muestran deformaciones presentes en alevín de salmón del Atlántico tras un evento ambiental que generó elevada mortalidad en el lote. Como se aprecia, existe en parte de los sobrevivientes una reducción de la capacidad volumétrica para el intercambio gaseoso, que posiblemente no incidirá en la vida del pez, pero sí generará probablemente un individuo con limitaciones productivas.

Figura 1. Deformación en cavidad opercular en Alevín (peso aprox 7 g). A: cavidad opercular normal. B: Se observa reducción de la cavidad branquial (Cb) debido al crecimiento de la musculatura hipoaxial (Mh), la cual se va introduciendo en el espacio entre branquias y el opérculo (Op), disminuyendo el volumen para un óptimo intercambio gaseoso.
Lo relevante es que situaciones de este tipo también repercuten y son observables a otros niveles, como en branquias y aletas, donde se activan procesos de regeneración (Figuras 2 y 3) que paradójicamente lo afectan a sí mismo y que pueden ser reversibles si las condiciones lo permiten, de lo contrario persisten. La Ontogenia, que permite realizar la evaluación en el tiempo, evalúa la evolución, de manera de saber si la reversibilidad se expresó de buena forma y recuperó toda su viabilidad productiva o, en caso contrario, esta fue nula o mínima, lo que genera un pronóstico reservado o desfavorable en términos productivos.
Figura 2. Branquia de salmón del Atlántico adulto: activación de un proceso de regeneración de tejido branquial con formación de un nuevo filamento. Se observa aumento del calibre de vasos sanguíneos (VS) y proliferación de musculatura lisa (ML).
En este sentido, es preciso recalcar que mientras más jóvenes son los individuos expuestos a condiciones ambientales adversas o subóptimas y mientras más dure la exposición, más intensas suelen ser las expresiones de respuesta regenerativa que podrían terminar finalmente convirtiéndose, por ejemplo, en deformaciones, desmejorándose el pronóstico ya que el nivel de respuesta regenerativa va perdiéndose con la edad (Figura 3).

Figura 3. Branquia de salmón del Atlántico reproductor. Se observa la típica respuesta proliferativa del epitelio branquial, caracterizada por hiperplasia y fusión lamelar. No obstante, a pesar de existir un alto incremento en la cantidad de vasos sanguíneos (angiogénesis), no se evidencian cambios tisulares propios de un proceso regenerativo branquial.

Figura 4. Aleta caudal alevín. La flecha indica desviación en lepidotriquias, componentes de la estructura ósea de la aleta caudal. Esta deformación se asocia a eventos de hipoxia tisular que pueden ser correlacionadas con alteraciones en otras estructuras como las branquias.
Como se observa en la foto (Figura 4), la estructura regenera, pero se mantiene un registro orgánico permanente que permitirá en el futuro (ej. smolt, engorda) una evaluación radiológica e histológica complementarias para evaluar el nivel de daño y exposición de los peces a condiciones detrimentales. Lo relevante de la Ontogenia, como en este caso, al complementarse con las otras técnicas, es que analiza el presente, se va al pasado a buscar su origen morfológico y/o embriológico y se mueve al futuro para generar un pronóstico, contribuyendo de manera importante al esclarecimiento de potenciales hechos y trazabilidad.
En ADL, como hemos comentado, llevamos más de 2 años trabajando estás temáticas, “construyendo puentes” y asociaciones entre lo productivo, clínico, patológico, fisiológico y ontogénico. Para esto hemos implementado un trabajo colaborativo con las Dras. Mariana Rojas, Méd. Vet. PhD y Carolina Smok, Méd. Vet. PhD (cand), reconocidas investigadoras y académicas de la Facultad de Medicina de la Universidad de Chile, y mediante una alianza estratégica con el laboratorio S&R Lab, quienes nos han aportado su conocimiento técnico y experiencia hemos podido implementar metodologías innovadoras que permiten una nueva y potente aproximación al diagnóstico. De esta forma hemos ido ganando experiencia a través del análisis de diversos casos, parte de ellos de elevada complejidad, y con el aporte complementario de la histopatología y la Ontogenia, interpretar los resultados desde una perspectiva más amplia, usando lo mejor de cada técnica y especialista, y de este modo entregar información con base científica, novedosa y práctica que permita aportar a la toma de decisiones tanto sanitarias como productivas.
Seroprevalencia de Renibacterium salmoninarum en smolts de salmón del Atlántico negativos a BKD por qPCR
Nota Técnica N°3:
Elaborado por: Área Asistencia Técnica & Area I+D+i
La Enfermedad Bacteriana del Riñón (BKD), es la tercera causa de mortalidad asociada a enfermedades infecciosas en salmón del Atlántico y segunda causal para el uso de antimicrobianos, según reporte sanitario de Sernapesca 2022. Por ello, es relevante incluir nuevas o mejores herramientas que permitan una detección temprana del agente causal en salmónidos para una intervención oportuna.
Actualmente, existen métodos de detección bastante sensibles, como el qPCR, que permite un tamizaje previo al inicio de cada ciclo productivo en el mar. Sin embargo, un problema frecuente en agua dulce, es la dificultad de pesquisar de manera objetiva los peces portadores (sanos) al agente causal de BKD y así tener una detección temprana a través de qPCR, cuando la población se encuentra en buenas condiciones de salud.
La detección de anticuerpos específicos contra el patógeno nos permite evaluar si el animal ha interaccionado con el patógeno. Es el caso en donde la población no está cursando un cuadro clínico y la carga bacteriana es baja, pero puede llegar a generar más tarde presentación clínica en mar, en especial en las regiones con mayor casuística. Esta situación es lo más común en agua dulce. A la fecha, no se ha explorado o confrontado resultados serológicos con aquellos provenientes de métodos moleculares como qPCR.
Desde hace algunos años, ADL Diagnostic comenzó a desarrollar su línea de trabajo para la generación de cepas atenuadas de R. salmoninarum en el marco de su proyecto de vacuna viva atenuada contra BKD. Complementariamente, desarrollamos un método inmunoenzimático (ELISA) altamente específico y sensible que permite detectar y evaluar la seroprevalencia a R. salmoninarum. Así entonces, hemos conducido estudios en animales y comparado ambas técnicas, realizando ELISA IgM anti- R. salmoninarum en suero (seroprevalencia) y paralelamente, llevamos a cabo qPCR para la detección del patógeno en muestras de tejido de órganos internos de los mismos peces.
De manera gráfica, se muestran los resultados para 10 grupos de smolt analizados (universo de 100 peces). Contrario a lo esperado, se aprecia que en la mayoría de ellos, correspondiente a 7 grupos, aparecen individuos seropositivos. Esto pudiese estar relacionado a la exposición al patógeno durante la fase de agua dulce. Resulta interesante comentar, que ninguno de estos peces resultó positivo a qPCR en muestras de riñón. No obstante, se detectó un nivel de 8% de positividad en el bazo, con la misma técnica.

ELISA IgM anti-R. salmoninarum de grupos de smolt de salmón del Atlántico. Cada grupo se muestreó previo a su traslado al mar. Línea discontinua representa el punto de corte que determina si un individuo es seropositivo. El grupo M4 en fase de engorda fue el único que presentó peces con signos clínicos y mortalidad por BKD.
El uso de ELISA IgM anti-R. salmoninarum constituye una herramienta interesante y potente para la detección temprana de peces portadores en agua dulce. En el caso de los smolts, la seropositividad puede estar asociada a un riesgo mayor de presentación de BKD en el mar. Un estudio preliminar de seguimiento hecho por ADL Diagnostic a los mismos grupos de smolt de la figura anterior, indicó en efecto, que el grupo con mayor nivel de seropositividad en agua dulce (M4) fue aquel que presentó BKD clínico en engorda.
En ADL Diagnostic seguimos avanzando en la investigación, extendiendo este estudio a alevines y reproductores. Los nuevos antecedentes que vayan surgiendo se irán informando a nuestros clientes.
Evolución en el tiempo de Genogrupos y Genovariantes de Piscirickettsia salmonis
Compartimos con ustedes publicación en Salmonxpert en relación a nuestras investigaciones realizadas en cuanto a la evolución en el tiempo de Genogrupos y Genovariantes de Piscirickettsia salmonis (SRS) y su relación con la respuesta a antimicrobianos.
FURUNCULOSIS ATÍPICA: actualización sobre el agente causal y la respuesta a Amicrobianos Nota Técnica N°1:
Nota Técnica N°1:
20 Marzo 2023
Elaborado por: Área Asistencia Técnica & Area I+D+i
A mediados del 2022, ADL Diagnostic Chile realiza la primera alerta en agua dulce de Furunculosis Atípica en salmón del Atlántico (Salmonexpert, 22.05.22).Desde su primera detección en Chile, hace ya casi 28 años, la casuística de esta enfermedad/agente ha tenido oscilaciones a través de los años, no obstante la mayor parte del tiempo ha estado casi erradicada, como consecuencia de la efectividad de las vacunas existentes, incorporadas desde el 2002. Sin embargo, desde el segundo semestre del 2021 se comenzó a observar un importante incremento en la detección del agente causal y/o de la enfermedad, casi todos ellos en agua dulce (pisciculturas de flujo abierto y recirculación), afectando a poblaciones de diversa talla, desde alevines hasta smolt, e incluso post-smolt. Una parte de estos casos debió ser controlada mediante quimioterapia (florfenicol y oxitetraciclina), ya sea oral o mediante vía intraperitoneal.

Durante el segundo semestre del 2022, la problemática emergente motivó al laboratorio a la generación de un acuerdo de investigación conjunta entre los especialistas del laboratorio, liderado por el Dr. Marcos Mancilla, Director del Área de I+D+i, y el Laboratorio de Patología de Organismos Acuáticos y Biotecnología en Acuicultura de la Universidad Andrés Bello (UNAB), liderado por el Dr. Rubén Avendaño-Herrera (y científico del INCAR). El estudio contempló el trabajo con una fracción importante de la colección de 54 aislados de ADL obtenidos desde 2013 a mayo de 2022, abordando tres objetivos fundamentales:
La caracterización genotÍpica y fenotÍpica de aislados de Aeromonas salmonicida atÍpica, obtenidos desde diversos centros de cultivo y áreas geográficas.
Estudiar la respuesta in vitro de estos aislados a Florfenicol y Oxitetraciclina a través de la determinación de la Concentración Inhibitoria Mínima (CIM), y finalmente.
Mejorar u optimizar el algoritmo diagnóstico en ADL.
Parte de estos aislados fueron obtenidos de casos que presentaron signología clínica característica de la enfermedad con brotes asociados y otros en condición subclínica.
Respecto de la caracterización
Los resultados indicaron que todos los aislados confirmados por PCR como pertenecientes al grupo de A. salmonicida atípica, comparten la misma huella genómica con una similitud del 100%, independiente del método de tipificación empleado.
Se descartó además, la presencia de Aeromonas salmonicida subsp. salmonicida, agente causal de la Furunculosis clásica o típica, presente en el hemisferio norte, detectandose únicamente la versión atípica de la subespecie. Con la excepción de un aislado que se posiciona junto a la cepa NCIMB 1110 de la especie A.salmonicida subsp. achromogenes, todos los restantes aislados se posicionaron más cercanos a A.salmonicida subsp. mausocida ATCC 27013. Esto es importante de destacar ya que por años se pensaba que probablemente la subespecie más frecuente en Chile era achromogenes.
Árboles filogenéticos enraizados basados en 16S ARNr (a), gyrB (b), que muestran relaciones en el género Aeromonas.

Respuesta bacteriana a antimicrobianos
Los resultados mostraron también que la mayoría de los aislados son del Qpo wild-type o silvestres, es decir susceptibles a los antimicrobianos testeados. No obstante, aparecen aislados “non-wild-type” (NWT), del total, 2 aislados expresan dicha condición para FFC y 4 para OTC.

Solo 2 de ellos tienen susceptibilidad reducida notoria a ambos antibióticos, pudiendo ser considerados muy probablemente como resistentes. La tabla de abajo muestra los resultados obtenidos, de los cuales se calcula el cut-off o valor de corte para ambos antibióticos, siendo para FFC ≤ 4,0 ug/mL y para OTC ≤ 1,0 ug/mL.
Para los efectos del estudio, el porcentaje de non wild-type para FFC es de 10% y para OTC es de 5%.
De acuerdo con los datos actualizados en el Clinical and Laboratory Standards Ins(tute (CLSI) para Aeromonas salmonicida atípica, la CIM de los aislados chilenos para Florfenicol y Oxitetraciclina se mueven en valores cercanos a los encontrados en este estudio.
Consideraciones finales
a) Es importante señalar que, si bien la casuística de A. salmonicida atípica en la actualidad ha ido paulatinamente bajando, esta enfermedad aún representa ser un desafío importante en agua dulce, en especial en RAS, no sólo por las pérdidas que podría generar sino también por la necesidad de usar antibióticos, en especial afectando a aquellas poblaciones cuyo objetivo comercial es ser “libres de antibióticos”.
b) La utilización de vacunas (inmersión) tempranamente en agua dulce ha contribuido a reducir los casos clínicos, de manera que esta práctica resulta ser beneficiosa y necesaria, complementandose con la vacuna polivalente inyectable que busca prevenir los casos en mar. No es necesario que haya casos clínicos o positividad en el centro de agua dulce para que se usen las vacunas de inmersión, consideramos que debería ser una práctica habitual, no es necesario ni adecuado esperar a estar positivos para comenzar a implementarla, los riesgos de introducir el agente al centro existen y como tal es conveniente adoptar políticas rigurosas.
c) El uso de antibiogramas para testear la susceptibilidad o resistencia de esta bacteria frente a los antimicrobianos, si bien es una práctica necesaria y habitual , en este caso, a la fecha, no proporciona resultados objetivos, se presentan desviaciones, semejante a Tenacibaculum spp y R.salmoninarum; por lo que es necesario que se desarrollen investigaciones para validarla como tal. La técnica válida para estos propósitos es la Concentración Inhibitoria Mínima (CIM), la que sólo puede realizarse a partir de aislados bacterianos.
d) Es relevante mantener una permanente vigilancia epidemiológica, no sólo realizada en peces sino buscando el agente causal en otros reservorios. El uso de ADLMag®, técnica inmunomagnética desarrollada por ADL hace algunos años, que posee una sensibilidad superior al qPCR en más de 1.000 veces, ha permitido eventualmente detectar el agente en agua, biofiltro y estanques de traslado.
e) La experiencia nos indica que hay que poner muy especial atención al estrés como un importante gatillante de la enfermedad, en especial cuando éste es de origen múltiple y se presenta de manera simultánea, como por ejemplo: alta densidad + esmoltificación, alta densidad y vacunación, etc.
f) Ciertamente, como todos sabemos, la clave está en implementar altos estándares de bioseguridad, lo que permitirá minimizar de manera importante los riesgos.
REFERENCIAS
Nilsson WB, Gudkovs N & Strom MS (2006). Atypical strains of Aeromonas salmonicida contain multiple copies of insertion element ISAsa4, useful as a geneAc marker and a target for PCR assay. Diseases of AquaAc Organisms 70, 209–217.
Yamamoto, S., & Harayama, S. (1998). Phylogenetic relationships of Pseudomonas pu0da strains deduced from the nucleotide sequences of gyrB, rpoD and 16S rRNA genes. International Journal of Systematic and Evolutionary Microbiology 48, 813–819.
Yáñez MA, Catalán V, Apráiz D, Figueras MJ & Mar]nez-Murcia AJ (2003). Phylogenetic analysis of members of the genus Aeromonas based on gyrB gene sequences. International Journal of Systematic and Evolutionary Microbiology 53, 875–883.
Kahlmeter, G., Brown D.F., Goldstein F.W., MacGowan A.P. Mouton, J.W., Osterlund, A., Rodloff, A., Steinbakk, M., Urbaskova, P., Vatopoulos, A. (2003). European harmonitazión of MIC breakpoints for antimicrobial susceptibility testing of bacteria. Journal of Antimicrobial Chemotherapy, 52, 145-148. doi 10.1093/jac/dkg312.
Miller, R. A., Reimschuessel, R. (2006). Epidemiologic cutoff values for antimicrobial agents against Aeromonas salmonicida isolates determined by minimal inhibitory concentration and diameter of zone of inhibition data. American Journal of Veterinary Research, 67(11), 1837-1843. doi 10.2460/ajvr.67.11.1837
Godoy, M., Gherardelli, V., Heisinger, A., Fernández, J., Olmos, P., Ovalle, L., ... & Avendaño-Herrera, R. (2010). First description of atypical furunculosis in freshwater farmed Atlantic salmon, Salmo salar L., in Chile. Journal of fish diseases, 33(5), 441-449
Evolución en el tiempo de Genogrupos y Genovariantes de Piscirickettsia salmonis (SRS) y su relación con la respuesta a antimicrobianos
Nota Técnica N°1:
28 Febrero 2023
Elaborado por: Área Asistencia Técnica & Area I+D+i
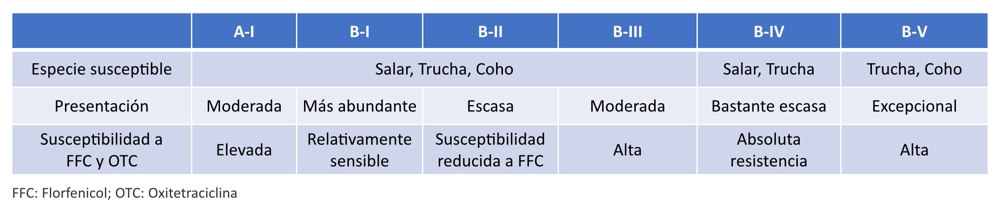
Investigaciones desarrolladas desde hace varios años por ADL, han documentado la existencia de 2 GENOGRUPOS diferentes de P. salmonis: Genogrupo A (similar a EM-90) y Genogrupo B (similar a LF-89), los cuales presentan no solo diferencias genómicas sino diferencias fenotípicas importantes, en donde el Genogrupo A presenta muy escasa variabilidad genética entre si (sólo una Genovariante) y es, además, altamente susceptible a Florfenicol y Oxitetraciclina. Por su parte, el Genogrupo B presenta mayor variabilidad genética entre si, lo que dio lugar a tener 5 GENOVARIANTES, cada una de ellas con características propias y, en especial, diferencias importantes en los patrones de respuesta a los principales antimicrobianos utilizados en acuicultura.
 A raíz de estas investigaciones, hace varios años ADL desarrolló RT-qPCR específicos para Genogrupos y Genovariantes utilizando los marcadores genéticos específicos acorde a las mutaciones genómicas detectadas, comenzando a trabajar con las empresas desde ese entonces. Los resultados son obtenidos en 48 horas, entregando información práctica, rápida, objetiva y muy relevante para la gestión sanitaria de nuestros clientes, permitiendo una mejor decisión y mayor precisión en la administración de las terapias antimicrobianas. A través de los años, se ha podido generar una valiosa información que permite distinguir las sorprendentes tendencias de estos últimos dos años (2021 – 2022), lo que ha contribuido a generar objetiva información respecto de la resistencia bacteriana de P. salmonis, así como establecer discusiones técnicas respecto de esta materia y la relación con las vacunas y programas de resistencia genética a SRS. En las siguientes gráficas, se observa la evolución de los Genogrupos y Genovariantes de P. salmonis en los últimos 8 años, considerándose una importante cantidad de análisis. Se evidencian relevantes cambios en la distribución de ambos y las diferencias entre especies de cultivo en el tiempo.
A raíz de estas investigaciones, hace varios años ADL desarrolló RT-qPCR específicos para Genogrupos y Genovariantes utilizando los marcadores genéticos específicos acorde a las mutaciones genómicas detectadas, comenzando a trabajar con las empresas desde ese entonces. Los resultados son obtenidos en 48 horas, entregando información práctica, rápida, objetiva y muy relevante para la gestión sanitaria de nuestros clientes, permitiendo una mejor decisión y mayor precisión en la administración de las terapias antimicrobianas. A través de los años, se ha podido generar una valiosa información que permite distinguir las sorprendentes tendencias de estos últimos dos años (2021 – 2022), lo que ha contribuido a generar objetiva información respecto de la resistencia bacteriana de P. salmonis, así como establecer discusiones técnicas respecto de esta materia y la relación con las vacunas y programas de resistencia genética a SRS. En las siguientes gráficas, se observa la evolución de los Genogrupos y Genovariantes de P. salmonis en los últimos 8 años, considerándose una importante cantidad de análisis. Se evidencian relevantes cambios en la distribución de ambos y las diferencias entre especies de cultivo en el tiempo.
GENOGRUPOS
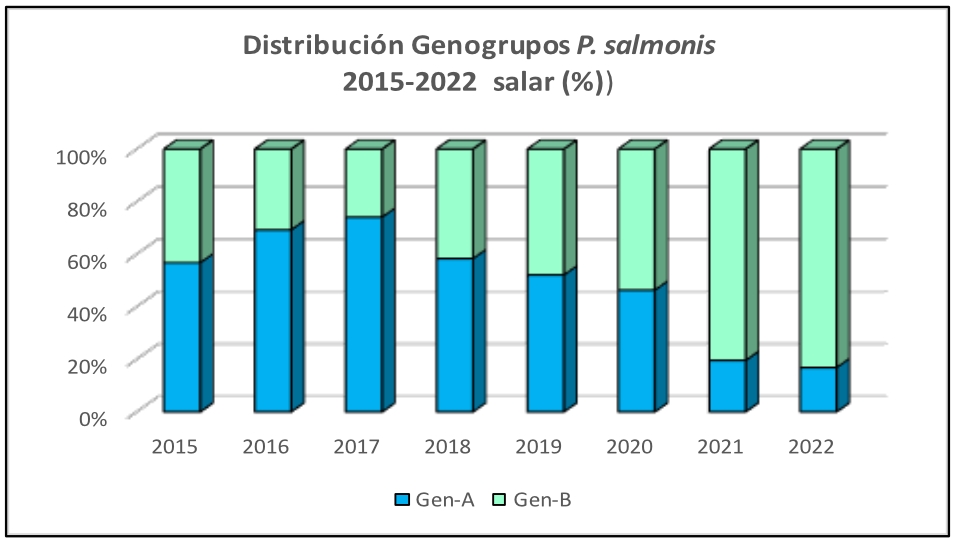
Imágen 1: Distribución Genogrupos P. salmonis 2015-2022 salar (%)
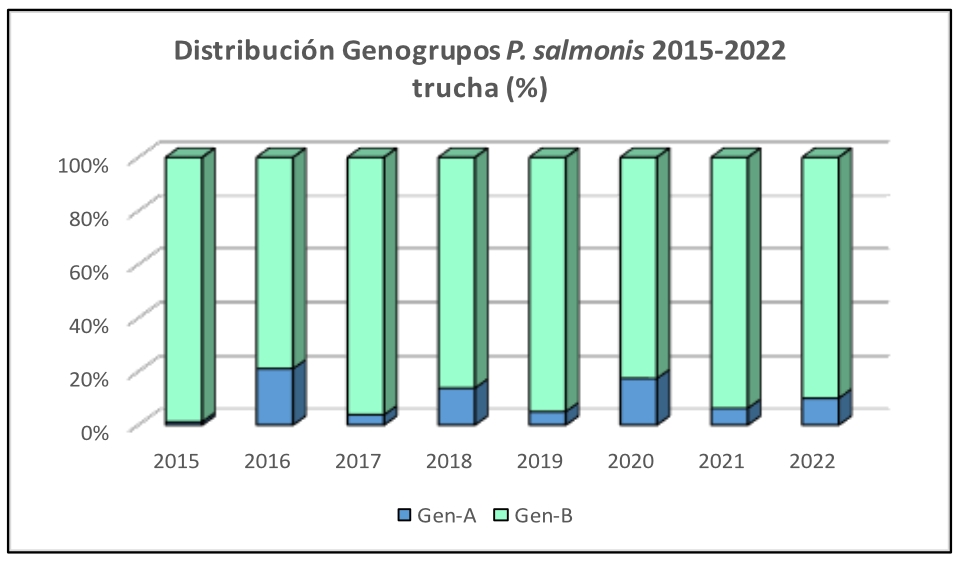
Imágen 2: Distribución Genogrupos P. salmonis 2015-2022 trucha (%)
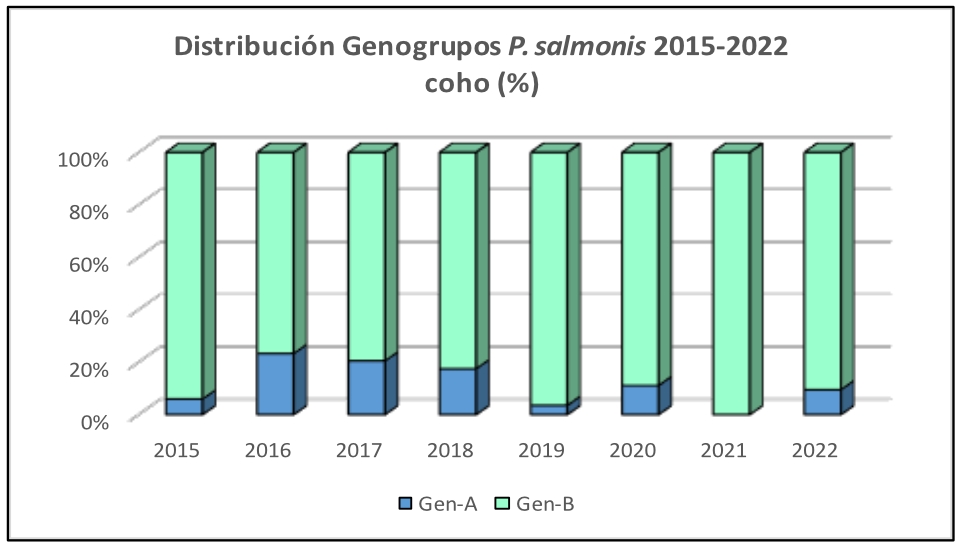
Imágen 3: Distribución Genogrupos P. salmonis 2015-2022 coho (%)
En los salares, se evidencia un incremento sostenido del Genogrupo B desde el año 2018 y especialmente notable desde el año 2021, mientras que en truchas y cohos se mantiene un claro predominio del Genogrupo B en el tiempo.
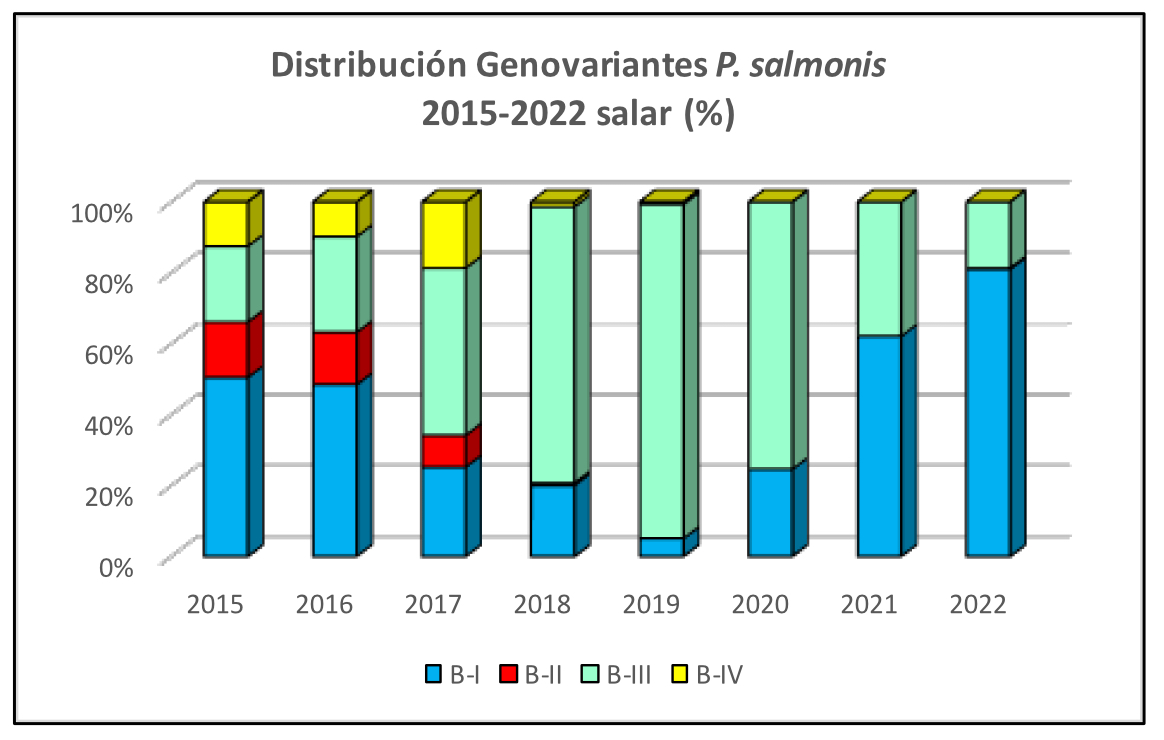
Imágen 4: Distribución Genovariantes P. salmonis 2015-2022 salar (%)
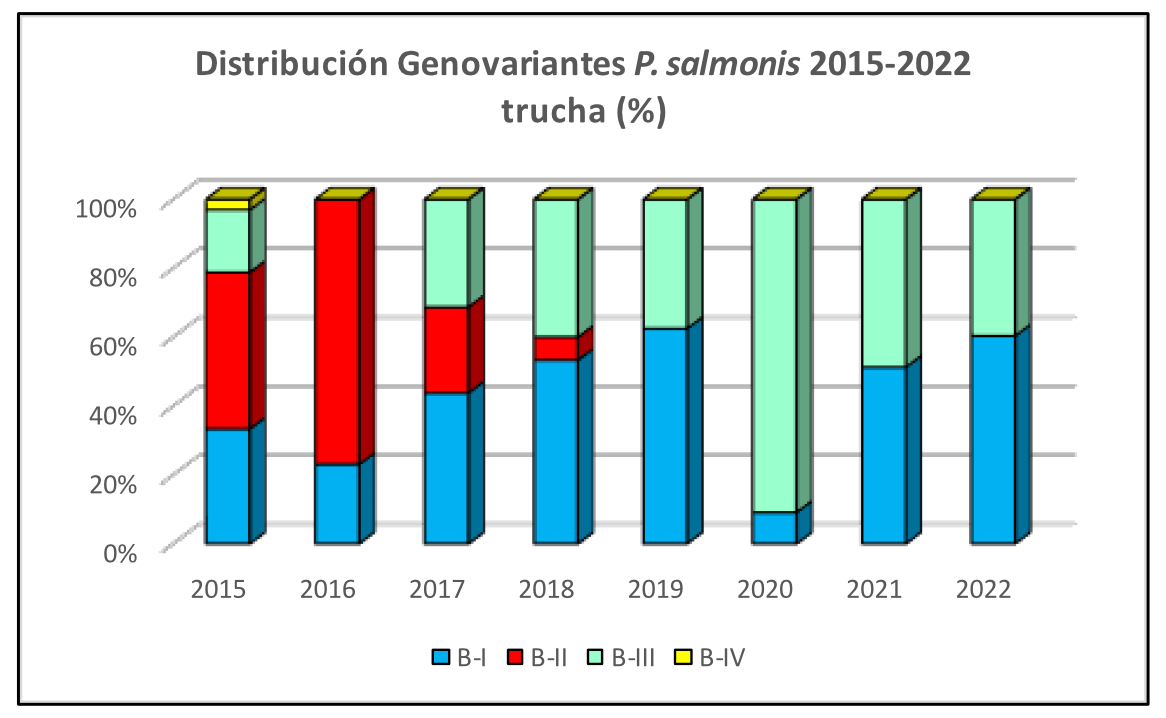
Imágen 5: Distribución Genovariantes P. salmonis 2015-2022 trucha (%)
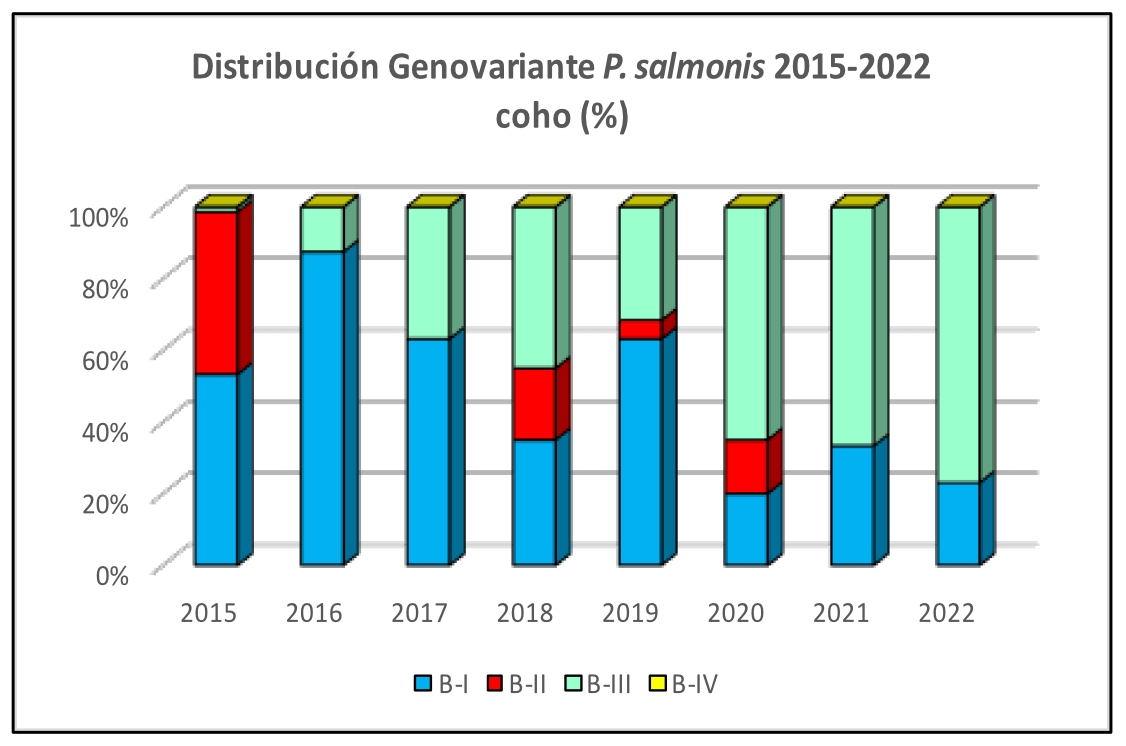
Imágen 6: Distribución Genovariante P. salmonis 2015-2022 coho (%)
Se observa en los últimos años un incremento relevante de la Genovariante B-I en truchas y salares, siendo actualmente la de mayor predominancia en ambas especies. En los cohos, persiste el predominio de la Genovariante B-III. Por otra parte, es notable la disminución de infecciones causadas por las Genovariantes B-II y B-IV desde el año 2018, con solo hallazgos excepcionales para B-II y sin detección de B-IV desde el año 2020.
Complementariamente, el análisis de 559 aislados de P. salmonis obtenidos por ADL desde el 2010 al 2022 (53,7% de Genogrupo A y 46,3% del Genogrupo B), permiten evidenciar diferencias relevantes en los valores de corte epidemiológicos con 4 a 8 veces mayor el valor de corte del CIM en genogrupo B, respecto de A.
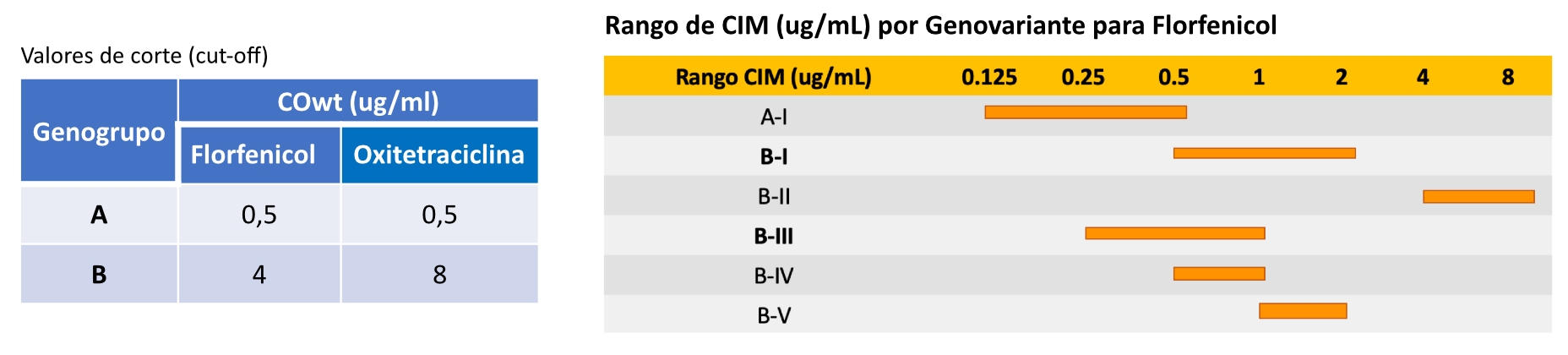
De esta manera, según el fenotipo de susceptibilidad, los aislados del Genogrupo A son más susceptibles y TODOS silvestres (wild-type) y responden “in vitro” muy bien a las terapias, mientras que los aislados del Genogrupo B son menos susceptibles a Florfenicol y Oxitetraciclina de manera que cuadros de SRS causados por éstos serán algo más difíciles de controlar. Por otra parte, que algunos aislados Genogrupo B sean no silvestres (non-wild-type) no significa que sean “resistentes” clínicamente, a excepción de la Genovariante B-IV. Recomendamos mantener un monitoreo estricto en el tiempo de los genogrupos y genovariantes presentes en los centros de cultivos como elemento de apoyo en la toma de decisiones en la prevención y control de la piscirickettsiosis.
Referencias:

DESCARGAR DOCUMENTO EN VERSION PDF